Teoría atómica de Democrito y Leucipo:
Demócrito pensó en la idea de que todos los cuerpos materiales son agregados de innumerables partículas tan pequeñas que no son visibles por los ojos humanos , los llamaron átomos (del griego indivisibles). Creía que había cuatro clases diferentes de átomos: los átomos de la piedra, pesados y secos; los átomos de agua, pesados y húmedos; los átomos de aire, fríos y ligeros, y los átomos de fuego, fugitivos y calientes

Por una combinación en estas cuatro clases de átomos se suponía que están hechas todas las materias conocidas. El suelo seria una combinación de átomos de piedra y agua. Los de una planta serian átomos de piedra y agua, procedentes del suelo y átomos de fuego procedentes del sol. Por esta causa los troncos de madera seca que han perdido átomos de agua pueden arder, desprendiendo átomos de fuego (llamas) y dejando átomos de piedra(cenizas).
Esta teoría que propuso Leucipo y Demócrito no tubo gran aceptación entre los filósofos griegos y romanos, así que el átomo fue olvidado ya que la teoría de que el universo estaba compuesto por cuatro elementos (tierra, agua, fuego y aire), resulto mucho más popular, aceptada y propagada por “eruditos”, como Aristóteles.
Teoría atómica de Dalton
 |
2. Hay distintas clases de átomos que se distinguen por su masa y sus propiedades. Todos los átomos de un elemento poseen las mismas propiedades químicas. Los átomos de elementos distintos tienen propiedades diferentes. |
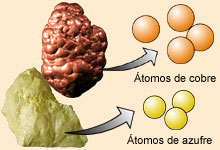
3. Los compuestos se forman al combinarse los átomos de dos o más elementos en proporciones fijas y sencillas. De modo que en un compuesto los de átomos de cada tipo están en una relación de números enteros o fracciones sencillas.
Modelo Atómico: |  |
 Fue el primer modelo atómico con bases científicas, fue formulado en 1804 por John Dalton. Este primer modelo atómico postulaba:La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.Los átomos, al combinarse para formar compuestos guardan relaciones simples.Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.Sin embargo desapareció ante el modelo de Thomson ya que no explica los rayos catódicos ni la radioactiviadad.
Fue el primer modelo atómico con bases científicas, fue formulado en 1804 por John Dalton. Este primer modelo atómico postulaba:La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.Los átomos, al combinarse para formar compuestos guardan relaciones simples.Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.Sin embargo desapareció ante el modelo de Thomson ya que no explica los rayos catódicos ni la radioactiviadad.
Estudios previos de la teoria de Thomson:
Otra observación que hace es que al frotar una barra de vidrio contra el trozo de piel, y al acercarla hacia los mismos cuerpos que no fueron atraídos por el ámbar, si son atraídos por la barra de vidrio; concluyendo que existen dos tipos de fuerzas de atracción.

Teoría atómica y el Modelo atómico de Thompson
Modelo atómico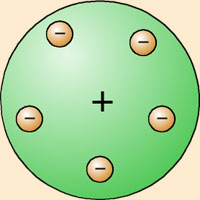 |
La identificación por J.J. Thomson de unas partículas subatómicas cargadas negativamente, los electrones, a través del estudio de los rayos catódicos, y su posterior caracterización, le llevaron a proponer un modelo de átomo que explicara dichos resultados experimentales. Se trata del modelo conocido informalmente como el pudín de ciruelas, según el cual los electrones eran como 'ciruelas' negativas incrustadas en un 'pudín' de materia positiva. |
Repite los experimentos de Crooks de 20 años atrás cambiando placas positivas y negativas deflectando las descargas al interior de un tubo y determinó que las partículas a interior eran negativas. Después de varios años del descubrimiento del electrón se encontró el protón. Luego de descubrimiento de estas dos partículas Thomson dijo que estas cargas se distribuían a alrededor del átomo.

Estudios previos de la teoria de Rutherford:

Bequerel observo que estas radiaciones se descomponen a su vez en tres tipos de rayos, los cuales también tenían a su vez una carga, a estas radiaciones se les conoce como materiales radioactivos, por descomponerse en ciertas radiaciones que pueden penetrar en cualquier cuerpo.
| Nombre | Símbolo | Masa (uma) | Carga |
| Rayos Alfa | a | 4 | 2 + |
| Rayos Beta | b | 1/1837 | -1 |
| Rayos Gamma | g | 0 | 0 |
Teoría atómica y el Modelo atómico de Rutherford
Modelo atómico: | Según este modelo, en el átomo existía un núcleo central en el que se concentraba la casi totalidad de la masa, así como las cargas eléctricas positivas, y una envoltura o corteza de electrones (carga eléctrica negativa). Además, logró demostrar experimentalmente la mencionada teoría a partir de las desviaciones que se producían en la trayectoria de las partículas emitidas por sustancias radioactivas cuando con ellas se bombardeaban los átomos. |
Rutherford abandonó el antiguo modelo y sugirió un átomo nuclear, un átomo que posee dos zonas muy separadas:
- En la zona central o núcleo se encuentra la carga total positiva (protones) y la mayor parte de la masa del átomo aportada por los protones y los neutrones.
- En la zona externa o corteza del átomo se hallan los electrones, que ocupan casi todo el volumen atómico y una pequeñísima parte de la masa del átomo.
átomo que tiene un núcleo central en el cual la carta positiva y la masa están concentradas. La carga positiva de los protones está compensada con la carga negativa de los electrones que se hallan fuera del núcleo. El núcleo contiene, por tanto, protones en un número igual al de electrones del átomo, más los neutrones necesarios para justificar la masa del átomo.
Estudios previos de la teoria de Borh:
Todas estas teorías experimentaciones e investigaciones dieron origen al concepto de que el átomo es divisible y que existen tres partículas fundamentales formándolo, por lo que ahora queda establecer como es este átomo con sus tres partículas para lo cual se establecieron diversos modelos atómicos.
No hay comentarios:
Publicar un comentario